|
|
| 1行目: |
1行目: |
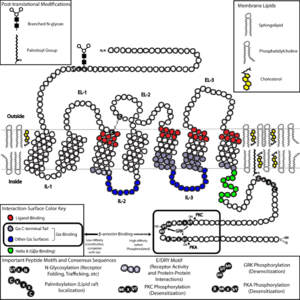
| | [[画像:GPCR in membrane.png|thumb|300px|典型的なGタンパク質共役受容体の模式図。[[N末端]]が細胞外に、[[C末端]]が細胞内にあり、7つの膜貫通ドメインと細胞内と細胞外にそれぞれ3つずつループがある。]] | | [[画像:GPCR in membrane.png|thumb|300px|典型的なGタンパク質共役受容体の模式図。[[N末端]]が細胞外に、[[C末端]]が細胞内にあり、7つの膜貫通ドメインと細胞内と細胞外にそれぞれ3つずつループがある。]] |
| | | | |
| − | '''Gタンパク質共役受容体'''(ジータンパクしつきょうやくじゅようたい、{{lang-en-short|G protein-coupled receptor}}、'''GPCR''')は、生体に存在する[[受容体]]の形式の1つである。様々な機能を持ったGタンパク質共役受容体が見られ、既知のタンパク質の中では最大の[[スーパーファミリー]]を形成している。別名として'''Gタンパク質結合受容体'''、あるいは細胞膜を7回貫通する特徴的な構造から{{読み仮名|'''7回膜貫通型受容体'''|ななかいまくかんつうがたじゅようたい}}<ref>{{lang-en-short|seven transmembrane receptor}}、7TM</ref>と呼ばれることもある。細胞外の[[神経伝達物質]]や[[ホルモン]]を受容してそのシグナルを細胞内に伝えるが、その際[[Gタンパク質]]<ref>{{lang-en-short|large G protein}}</ref>と呼ばれる三量体タンパクを介して[[シグナル伝達]]が行われる。Gタンパク質共役受容体には様々な種類が存在し、多くの疾患に関与しているため、市販薬の数割がGタンパク質共役受容体のうちのいずれかを標的としている<ref>{{cite journal|first=David|last=Filmore|pages=24–28|title=It's a GPCR world|journal=Modern Drug Discovery|volume=2004|year=2004|issue=November|publisher=American Chemical Society|url=http://pubs.acs.org/subscribe/journals/mdd/v07/i11/html/1104feature_filmore.html}}</ref>。 | + | '''Gタンパク質共役受容体'''(ジータンパクしつきょうやくじゅようたい、{{lang-en-short|G protein-coupled receptor}}、'''GPCR''') |
| | | | |
| − | == 歴史 ==
| + | ヒトの細胞表面にあって、細胞外の刺激によって細胞内にあるGたんぱく質を変化させ、細胞外の刺激を細胞内に伝える役割をもつ受容体。Gたんぱく質とは、グアニンヌクレオチド結合性調節たんぱく質(guanin nucleotide connective regulator protein)の略称で、セカンドメッセンジャー・カスケード(second messenger cascade ホルモンに続く第二のメッセンジャーである情報伝達物質が、酵素の活性などの段階を経て細胞応答に導くこと)に関連するたんぱく質のファミリー。アドレナリンのようなホルモンが直接細胞に働きかけて、血圧上昇や心拍数増加を引き起こすことは19世紀から知られており、細胞の表面にホルモンを受け取るものが存在していると考えられていたが、その正体は不明であった。アメリカのデューク大学のR.J.レフコウィッツ(Robert Joseph Lefkowitz)教授の研究チームは、種々のホルモンをヨウ素の放射性同位体で標識、追跡して、1968年、細胞表面にあるβ-アドレナリンの受容体を発見し、その機能を解明した。さらに1980年代、新たに研究に加わったスタンフォード大学のB.K.コビルカ(Brian Kent Kobilka)教授は、β-アドレナリン受容体の設計図となる遺伝子を分離・解析して、β-アドレナリン受容体が目の中にある光を感じ取る受容体と似ていることを発見した。また、β-アドレナリン受容体がホルモンによって活性化される瞬間を捉えることにも成功した。現在、医薬品の大半は、Gたんぱく質共役受容体を通じてその機能を発現している。このためGたんぱく質共役受容体の研究は、新薬の開発には欠かせないものとなっている。レフコウィッツとコビルカは「Gたんぱく質共役受容体の研究」によって2012年ノーベル化学賞を受賞した。 |
| − | 1986年、網膜に存在する光受容体ロドプシンと、心臓に存在するβ2アドレナリン受容体(β2AR)が発見された。この2つの分子は、限局している領域も機序も異なるタンパク質ではあったが、「膜を7回貫通している」という構造的な共通点が存在した。最初のGタンパク質共役受容体の結晶構造が2000年にウシの網膜から精製したロドプシンで[[構造決定|決定]]され<ref name="pmid10926528">{{cite journal|author=Palczewski K, Kumasaka T, Hori T, Behnke CA, Motoshima H, Fox BA, Trong IL, Teller DC, Okada T, Stenkamp RE, Yamamoto M, Miyano M|title=Crystal structure of rhodopsin: A G protein-coupled receptor.|journal=Science|volume=289|issue=5480|pages=739–45|year=2000|pmid=10926528|doi=10.1126/science.289.5480.739|issn=}}</ref>。それまで同じ7回膜貫通タンパク質であるバクテリオロドプシンの光駆動水素イオンポンプ構造モデルより、複雑な折れ曲りをもち、さらに7回貫通ヘリックスの後に短い8番目のヘリックスがあるGタンパク質共役受容体に共通の構造が明らかになった。
| |
| − | | |
| − | そして、2007年に[[ブライアン・コビルカ]]とReymond Stevesたちにより、医薬品標的として初めて、昆虫細胞で発現したβ2-アドレナリン受容体T4リゾチームキメラタンパク質の結晶構造が決定され<ref name="Rasmussen_2007">{{cite journal|author=Rasmussen SG, Choi HJ, Rosenbaum DM, Kobilka TS, Thian FS, Edwards PC, Burghammer M, Ratnala VR, Sanishvili R, Fischetti RF, Schertler GF, Weis WI, Kobilka BK|title=Crystal structure of the human β<sub>2</sub>-adrenergic G-protein-coupled receptor|journal=Nature|volume=450|issue=7168|pages=383–7|year=2007|pmid=17952055|doi=10.1038/nature06325|issn=}}</ref>、2011年の極めて精緻な結晶化技術を駆使して、活性化状態のβ2-アドレナリン受容体とG-タンパク質三量体の結晶構造がコビルカたちのグループによって決定され、コビルカのボスでGタンパク質共役受容体の機能解析の専門家である[[ロバート・レフコウィッツ]]とともに翌年の[[ノーベル化学賞]]を受賞した<ref name="Nobel committee,2012">{{cite news|last=Royal Swedish Academy of Sciences|title=The Nobel Prize in Chemistry 2012 Robert J. Lefkowitz, Brian K. Kobilka|url=http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2012/press.html|accessdate=10 October 2012|date=10 October 2012}}</ref>。現在までにロドプシン・ファミリーであるクラスAはもちろんクラスB、クラスC、クラスFの立体構造がすでに解かれている。
| |
| − |
| |
| − | == 分類 ==
| |
| − | Gタンパク質共役受容体は、アミノ酸配列や機能の類似に基づいて6つのクラスに分類されている<ref>{{cite journal|author=Attwood TK, Findlay JB|title=Fingerprinting G-protein-coupled receptors|journal=Protein Eng|year=1994|volume=7|issue=2|pages=195–203|pmid=8170923|url=http://peds.oxfordjournals.org/cgi/reprint/7/2/195|doi=10.1093/protein/7.2.195}}</ref><ref>{{cite journal|author=Kolakowski LF Jr|title=GCRDb: a G-protein-coupled receptor database|journal=Receptors Channels|year=1994|volume=2|issue=1|pages=1–7|pmid=8081729}}</ref><ref>{{cite journal|author=Foord SM, Bonner TI, Neubig RR, Rosser EM, Pin JP, Davenport AP, Spedding M, Harmar AJ|title=International Union of Pharmacology. XLVI. G protein-coupled receptor list|journal=Pharmacol Rev|year=2005|volume=57|issue=2|pages=279–88|pmid=15914470|doi=10.1124/pr.57.2.5}}</ref><ref>[http://www.ebi.ac.uk/interpro/ISearch?query=gpcr InterPro]</ref>。
| |
| − | | |
| − | ;クラス A:[[ロドプシン]]様受容体
| |
| − | ;クラス B:[[セクレチン]]受容体ファミリー
| |
| − | ;クラス C:[[代謝性グルタミン酸受容体]]
| |
| − | ;クラス D:[[真菌]]の接合因子受容体
| |
| − | ;クラス E:[[サイクリックAMP]](cAMP)受容体
| |
| − | ;クラス F:{{仮リンク|フリズルド|en|Frizzled}}、{{仮リンク|スムーセンド|en|Smoothened}}
| |
| − | | |
| − | ロドプシン様クラスA受容体は、さらに19のサブグループに分けられている(A1-A19)<ref>{{cite journal|author=Joost P, Methner A|title=Phylogenetic analysis of 277 human G-protein-coupled receptors as a tool for the prediction of orphan receptor ligands|journal=Genome Biol|year=2002|volume=3|issue=11|pages=research0063.1–0063.16|pmid=12429062|doi=10.1186/gb-2002-3-11-research0063}}</ref>。最近、GRAFS という別の分類法が提案された。これは、代謝型グルタミン酸受容体・ロドプシン・接着因子受容体・フリズルド/苦味受容体・セクレチン受容体の5つに分類するものである<ref>{{cite journal|author=Bjarnadottir TK, Gloriam DE, Hellstrand SH, Kristiansson H, Fredriksson R, Schioth HB|title=Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse|journal=Genomics|year=2006|volume=88|issue=3|pages=263–73|pmid=16753280|doi=10.1016/j.ygeno.2006.04.001}}</ref>。
| |
| − | | |
| − | ヒトゲノムには約800種類のGタンパク質共役受容体がコードされており、これらはホルモンや成長因子をはじめとする内因性リガンドを認識する。ヒトのGタンパク質共役受容体のうち半数は臭い受容体であり、約30種類は、まだリガンドや働きが分かっていないオーファン受容体である。
| |
| − | | |
| − | == 種類 ==
| |
| − | <!-- いずれ整理します -->
| |
| − | ;[[ムスカリン性アセチルコリン受容体]]:神経伝達物質アセチルコリンの受容体の1種で、キノコ由来の毒物ムスカリンを結合する特徴がある。
| |
| − | ;[[アデノシン受容体]]:神経伝達物質[[アデノシン]]の受容体。[[カフェイン]]も結合する。
| |
| − | ;[[アドレナリン受容体]]:[[アドレナリン]]やその他の構造が類似したホルモン、薬物を結合する。
| |
| − | ;[[GABA受容体 (B型)]]
| |
| − | ;[[アンギオテンシン受容体]]:[[アンギオテンシン]]の受容体
| |
| − | ;[[カンナビノイド受容体]]:[[大麻]]成分および[[アナンダミド]]等の内在性リガンドを結合する。
| |
| − | ;[[コレシストキニン受容体]]:[[コレシストキニン]]の受容体
| |
| − | ;[[ドーパミン受容体]]:[[ドーパミン]]の受容体
| |
| − | ;[[オレキシン受容体]]:[[オレキシン]]の受容体
| |
| − | ;[[グルカゴン受容体]]:[[グルカゴン]]の受容体
| |
| − | ;[[ヒスタミン受容体]]:[[ヒスタミン]]の受容体
| |
| − | ;[[嗅覚受容体]]:嗅覚細胞にある、におい物質の受容体。(2004年度ノーベル生理学・医学賞対象)
| |
| − | ;[[オピオイド受容体]]:[[アヘン]]成分および内在性ペプチド性リガンド([[エンケファリン]]、[[エンドルフィン]]等)を結合する。
| |
| − | ;[[ロドプシン]]:網膜にある光受容体。
| |
| − | ;[[セクレチン受容体]]:[[セクレチン]]の受容体
| |
| − | ;[[セロトニン受容体]]:[[セロトニン]](5-ヒドロキシトリプタミンまたは5-HT)の受容体(3型を除く)
| |
| − | ;[[ソマトスタチン受容体]]:[[ソマトスタチン]]の受容体
| |
| − | ;[[ガストリン受容体]]:[[ガストリン]]の受容体
| |
| − | ;[[P2Y受容体]]:[[アデノシン三リン酸|ATP]]など[[プリンヌクレオチド]]の受容体
| |
| − | | |
| − | == 構造 ==
| |
| − | Gタンパク質共役受容体は[[膜タンパク質]] であり、7本の[[膜貫通ヘリックス]]を持っている。 細胞外部分は[[グリコシル化]](糖鎖修飾)されていることもある。細胞外ループには2つのよく保存された[[システイン]]残基が含まれ、[[ジスルフィド結合]]によって受容体構造を安定化している。7回貫通型ヘリックスを持つ似たタンパク質には、イオンチャネルとして働く[[チャネルロドプシン]] のように、Gタンパク質共役受容体とはまったく異なる機能を持つものがある。
| |
| − | | |
| − | Gタンパク質共役受容体の構造の初期のモデルは、[[バクテリオロドプシン]] との弱い相同性に基づいていた。バクテリオロドプシンの構造は、1900年代に電子線回折({{PDB|2BRD}}, {{PDB2|1AT9}})<ref name="pmid8676377">{{cite journal|author=Grigorieff N, Ceska TA, Downing KH, Baldwin JM, Henderson R|title=Electron-crystallographic refinement of the structure of bacteriorhodopsin|journal=J. Mol. Biol.|volume=259|issue=3|pages=393–421|year=1996|pmid=8676377|doi=10.1006/jmbi.1996.0328|issn=}}</ref><ref name="pmid9296502">{{cite journal|author=Kimura Y, Vassylyev DG, Miyazawa A, Kidera A, Matsushima M, Mitsuoka K, Murata K, Hirai T, Fujiyoshi Y|title=Surface of bacteriorhodopsin revealed by high-resolution electron crystallography|journal=Nature|volume=389|issue=6647|pages=206–11|year=1997|pmid=9296502|doi=10.1038/38323|issn=}}</ref>や [[X線結晶回折法]] ({{PDB2|1AP9}})<ref name="pmid9287223">{{cite journal|author=Pebay-Peyroula E, Rummel G, Rosenbusch JP, Landau EM|title=X-ray structure of bacteriorhodopsin at 2.5 angstroms from microcrystals grown in lipidic cubic phases|journal=Science|volume=277|issue=5332|pages=1676–81|year=1997|pmid=9287223|doi=10.1126/science.277.5332.1676|issn=}}</ref>で解かれていた。
| |
| − | 2000年に、哺乳類のGタンパク質共役受容体の構造がウシの [[ロドプシン]] ({{PDB2|1F88}}) で初めて解明された<ref name="pmid10926528">{{cite journal|author=Palczewski K, Kumasaka T, Hori T, Behnke CA, Motoshima H, Fox BA, Trong IL, Teller DC, Okada T, Stenkamp RE, Yamamoto M, Miyano M|title=Crystal structure of rhodopsin: A G protein-coupled receptor.|journal=Science|volume=289|issue=5480|pages=739–45|year=2000|pmid=10926528|doi=10.1126/science.289.5480.739|issn=}}</ref>。7つの膜貫通ヘリックスなど大まかな構造はバクテリオロドプシンと似ていたが、ヘリックス同士の位置関係は大きく異なっていた。
| |
| − | 2007年に、[[ベータ-2アドレナリン受容体|β<sub>2</sub>-アドレナリン受容体]]の構造が解かれ、ヒトのGタンパク質共役受容体の構造が初めて明らかになった({{PDB2|2R4R}}, {{PDB2|2R4S}})<ref name="Rasmussen_2007">{{cite journal|author=Rasmussen SG, Choi HJ, Rosenbaum DM, Kobilka TS, Thian FS, Edwards PC, Burghammer M, Ratnala VR, Sanishvili R, Fischetti RF, Schertler GF, Weis WI, Kobilka BK|title=Crystal structure of the human β<sub>2</sub>-adrenergic G-protein-coupled receptor|journal=Nature|volume=450|issue=7168|pages=383–7|year=2007|pmid=17952055|doi=10.1038/nature06325|issn=}}</ref>。この構造は、受容体に抗体を結合して結晶化を補助する方法で得られた。
| |
| − | 続いて、受容体の第三細胞内ループを T4 [[リゾチーム]]で置換した変異体を[[脂質キュービック相]]の中で結晶化することにより、より高解像度の構造が得られた({{PDB2|2RH1}})<ref name="Cherezov_2007">{{cite journal|author=Cherezov V, Rosenbaum DM, Hanson MA, Rasmussen SG, Thian FS, Kobilka TS, Choi HJ, Kuhn P, Weis WI, Kobilka BK, Stevens RC|title=High-resolution crystal structure of an engineered human β<sub>2</sub>-adrenergic G protein-coupled receptor|journal=Science|volume=318|issue=5854|pages=1258–65|year=2007|pmid=17962520|doi=10.1126/science.1150577|issn=}}</ref><ref name="Rosenbaum_2007">{{cite journal|author=Rosenbaum DM, Cherezov V, Hanson MA, Rasmussen SG, Thian FS, Kobilka TS, Choi HJ, Yao XJ, Weis WI, Stevens RC, Kobilka BK|title=GPCR engineering yields high-resolution structural insights into β<sub>2</sub>-adrenergic receptor function|journal=Science|volume=318|issue=5854|pages=1266–73|year=2007|pmid=17962519|doi=10.1126/science.1150609|issn=}}</ref>。
| |
| − | 同様の手法で、ドーパミンD3受容体<ref name="pmid21097933">{{cite journal|author=Chien EY, Liu W, Zhao Q, Katritch V, Han GW, Hanson MA et al.|title=Structure of the human dopamine D3 receptor in complex with a D2/D3 selective antagonist.|journal=Science|year=2010|volume=330|issue=6007|pages=1091-5|pmid=21097933|doi=10.1126/science.1197410|pmc=PMC3058422|url=http://www.ncbi.nlm.nih.gov/entrez/eutils/elink.fcgi?dbfrom=pubmed&tool=sumsearch.org/cite&retmode=ref&cmd=prlinks&id=21097933 }} </ref>とCXCケモカイン受容体CXCR4<ref name="pmid20929726">{{cite journal|author=Wu B, Chien EY, Mol CD, Fenalti G, Liu W, Katritch V et al.|title=Structures of the CXCR4 chemokine GPCR with small-molecule and cyclic peptide antagonists.|journal=Science|year=2010|volume=330|issue=6007|pages=1066-71|pmid=20929726|doi=10.1126/science.1194396|pmc=|url=http://www.ncbi.nlm.nih.gov/entrez/eutils/elink.fcgi?dbfrom=pubmed&tool=sumsearch.org/cite&retmode=ref&cmd=prlinks&id=20929726 }} </ref>の構造も解かれた。
| |
| − | また、シチメンチョウのβ<sub>1</sub>受容体の熱安定化変異体の構造<ref name="pmid18594507">{{cite journal|author=Warne T, Serrano-Vega MJ, Baker JG, Moukhametzianov R, Edwards PC, Henderson R et al.|title=Structure of a beta1-adrenergic G-protein-coupled receptor.|journal=Nature|year=2008|volume=454|issue=7203|pages=486-91|pmid=18594507|doi=10.1038/nature07101|pmc=PMC2923055|url=http://www.ncbi.nlm.nih.gov/entrez/eutils/elink.fcgi?dbfrom=pubmed&tool=sumsearch.org/cite&retmode=ref&cmd=prlinks&id=18594507 }} </ref>も報告された。これらのGタンパク質共役受容体の構造は、7本の膜貫通ヘリックス部分ではウシのロドプシンとよく似ていた。しかし、ヘリックス同士を結ぶループ領域の構造はそれぞれ異なっていた。
| |
| − | | |
| − | 上記の構造はすべて、アンタゴニストや逆アゴニストが結合した非活性型コンフォメーションである。2011年になって、アゴニストが結合した活性型コンフォメーションと思われる構造が報告された。これらについては後述する。
| |
| − | | |
| − | == 構成 ==
| |
| − | [[画像:Beta2Receptor-with-Gs.png|thumb|270px|Gタンパク質共役受容体の1つであるβ2アドレナリン受容体とGタンパク質(Gs)の複合体の構造。赤色がGタンパク質共役受容体(β2R)で、緑色がGα、青色がGβで、黄色がGγである。]]
| |
| − | | |
| − | Gタンパク質共役受容体はN末端が細胞外に、C末端が細胞内にあり、[[αヘリックス]]からなる膜貫通(TM)ドメインが7カ所ある。
| |
| − | 一方、Gタンパク質共役受容体と共役している[[Gタンパク質]]はα(約40 kDa)、β(約35 kDa)、γ(約7〜8 kDa)の3つのサブユニットから構成されている。生理的環境においては、β及びγは互いに固く結合しており、Gβγ複合体と呼ばれる。一方、Gαには[[グアノシン三リン酸|GTP]]/[[グアノシン二リン酸|GDP]]結合部位が存在しており、ここにGDPが結合しているとき、Gタンパク質は不活性型として三量体構造Gαβγを取って、Gタンパク質共役受容体と結合している。2011年になってβ2アドレナリン受容体とGタンパク質の複合体の立体構造が解かれた<ref> {{Cite journal|author=Søren G. F. Rasmussen, Brian T. DeVree, Yaozhong Zou, Andrew C. Kruse, Ka Young Chung, Tong Sun Kobilka, Foon Sun Thian, Pil Seok Chae, Els Pardon, Diane Calinski, Jesper M. Mathiesen, Syed T. A. Shah, Joseph A. Lyons, Martin Caffrey, Samuel H. Gellman, Jan Steyaert, Georgios Skiniotis, William I. Weis, Roger K. Sunahara, Brian K. Kobilka|title=Crystal structure of the beta(2) adrenergic receptor-Gs protein complex|journal=[[Nature]]|year=2011|month=July|doi=10.1038/nature10361|pmid=21772288 }}</ref>。
| |
| − | {{clear}}
| |
| − | | |
| − | == Gタンパク質共役受容体の画像 ==
| |
| − | <gallery>
| |
| − | File:Beta-2 adrenergic receptor.png|アドレナリンβ2受容体の構造([[カラゾロール]]との複合体)
| |
| − | File:A2A receptor bilayer.png|アデノシンA2A受容体の構造
| |
| − | File:3PBL (D3).png|ドーパミンD3受容体の構造([[エチクロプリド]]との複合体)
| |
| − | File:3OE9 (CXCR4).png|[[ケモカイン受容体]]の1種であるCXCR4の構造(IT1tとの複合体)
| |
| − | </gallery>
| |
| | | | |
| | == 脚注 == | | == 脚注 == |
| | <references/> | | <references/> |
| − | | + | {{テンプレート:20180815sk}} |
| − | == 外部リンク ==
| |
| − | * {{Spedia|G_protein-coupled_receptor|G protein-coupled receptor}}
| |
| − | * [http://www.ecosci.jp/GPCR/ GPCR - 2012年ノーベル化学賞] Webサイト「生活環境化学の部屋」
| |
| − | * {{脳科学辞典|記事名=Gタンパク質共役型受容体}}
| |
| − | | |
| | {{DEFAULTSORT:Gたんはくしつきようやくしゆようたい}} | | {{DEFAULTSORT:Gたんはくしつきようやくしゆようたい}} |
| − | {{biosci-stub}}
| |
| | | | |
| | [[Category:シグナル伝達]] | | [[Category:シグナル伝達]] |
| | [[Category:受容体]] | | [[Category:受容体]] |
| | [[Category:Gタンパク質共役受容体|*]] | | [[Category:Gタンパク質共役受容体|*]] |